1.はじめに
生命科学の著しい進展により多くの遺伝子が日々同定されている現在、それら遺 伝子がコードする蛋白質の機能解析の重要性が再認識されつつある。一般に、蛋白 質分子の機能発現は相応する3次元構造に依存すると考えられちことから、蚤白質 の原子レベルでの3次元構造決定に対する需要も近年急速に高まってきた。こうし た状況に呼応して、Ⅹ線結晶構造解析法やNMRによる構造解析法を利用する構造 生物学に従事する研究者の人口はここ十数年来増加の一途を辿っている。
Ⅹ線結晶構造解析の分野では、放射光による高輝度Ⅹ線源の利用・2次元Ⅹ線検 出装置による測定の高速化・計算機の高速化・解析手法の発達等の様々な技術の発 展により構造解析全般に要する期間が飛躍的に短縮されてきた。ところが、Ⅹ線結 晶構造解析のために必要不可欠な蛋白質の結晶化については、条件探索に試行錯誤 が不可避なため実験期間の劇的な短縮は困難であった。そのため、結晶成長自体を 対象とする物性物理学の分野が近年活発化し、結晶調製についての新技術が開拓さ れつつあるにも係らず、「構造解析における律連投階は結晶化」と言われるように なって久しい。ここでは初めて結晶化を試みる研究者を対象として主に粒状蛋白質 の結晶化について椒説する。
2.結晶化とは
【蚤白質の結晶】
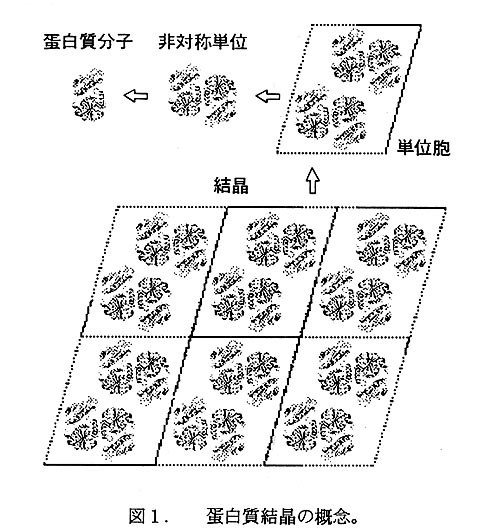
蛋白質の結晶を微視的に観察すると、中身が全く同一のある決まった大きさを持 つた平行四辺形が単位となり、それが3次元方向に規則正しく積み重なって格子構 造を形成している様子がわかる(図1)。この単位は「単位胞」と呼ばれ、その中 にはある決まった分子集合がある一定の対称関係を保ちつつ規則正しく充填されて いる0この分子集合は「非対称単位」と呼ばれ、その中身にはそれ以上の空間配置 の規則性は存在しない。結晶構造解析において決定されるのは、非対称単位間の対 称関係(空間群と格子定数)と非対称単位内の原子配列(原子の3次元座標)であ る。非対称単位には1分子の蛋白質が含まれる場合もあれば、複数の蛋白質分子が 会合して多量体を形成している場合もある。(図1では各単位胞中に2つの非対称単 位が、各非対称単位中に2分子の蚤白質が含まれている)。
ところで、蛋白質は一辺数〜数十nmの大きさを持つため、結晶形成の過程で単位 胞に隙間なく充填することはできず、分子同士の間に大きな空隙が生じる。 隙は結晶化に供した蚤白質溶液に含まれる水分子や添加剤分子等の溶媒分子によっ て埋められている0通常の蛋白質結晶では溶媒分子の含有率は0.3〜0.8程度で、蛋 白質分子同士の直接接触は限られた部分にしか見られない(図1)。従って、「生 きた蚤白質分子が濃厚溶液中で空間的に規則正しく配列している」といった記述が 蚕白質結晶を表現するのに相応しく、「結晶」という語感から想像される「干渦び た蚤白質分子が真空中で密に充填した」ようなものでは決してない。この性質は低 分子量化合物を含む溶液に蛋白質結晶を濠漬することによって酵素反応を進行させ たり、蛋白質のコンフオメーションを変化させることを可能とし、蛋白質分子の構 造と機能との相関を調べる上で都合が良い。一方、結晶中の蛋白質分子が取り得る コンフオメーションに自由度があるということは、結晶が本来持つべき厳密な空間 配置規則からの逸脱を意味し、結晶成長の阻害要因にもなり得る。また、一般に回 折Ⅹ線の強度は入射Ⅹ線の強度と結晶体積とに比例するので、結晶体積が小さけれ ばそれだけで精度よい回折強度は得にくくなる。さらに、結晶体積が十分であって も、蚤白質分子のコンフオメーションの自由度が高いほど回折Ⅹ線の最高分解能が 低減する(写真撮影に例えて言えば、撮影時に手振れが起これば像はピンボケとな る)。そこで、高分解能かつ高精度のⅩ線回折強度測定を行うには、十分な大きさ (通常一辺0.2mm程度)を持ち、一定条件下では個々の蛋白質分子のコンフオメー ションが揃っているような結晶が適していると言えよう。蛋白質の結晶を得ること 自体は特に困難ではなくても、上記のような品質の結晶を得ることは一般には決し て容易ではなく、多くの工夫と努力が必要となる。

【原理】
蛋白質溶液に対して溶解度を減少させるような物理化学的変化を与えていくと、 蚤白質分子は次第に溶存し難くなる。電白質の溶解度は溶液中の蛋白質濃度と様々 な物理化学的要因との関数と考えることができる。代表的な要因としては、水素イ オン濃度(pH)・イオン強度・添加剤の種類及び濃度・温度等が挙げられる。蛋白 質の溶解度を効果的に減少させる添加物質を沈殿剤と呼び、硫酸塩・リン酸塩・ク エン酸塩等の高溶解性多価塩、アルコール等の親水性有機溶媒、ポリエチレングリ コール(PEG)等の高分子化合物が多用されている。ちなみに、塩は蛋白質分子表 面の水和水の除去作用とイオン雰囲気の縮小作用によって、有機溶媒は蛋白質溶液 の誘電率の低下作用によって蛋白質の溶解度を低下させる。高分子化合物は両方の 作用を併せ持つ。一方、低イオン強度の溶液中や蛋白質の等電点付近のpHでは電白 質の溶解度は一般に低下する。蚤白質の結晶化では沈殿剤の添加に基づく方法が主 流をなすが、脱塩或いは帝釈により低イオン強度とする方法も用いられる。
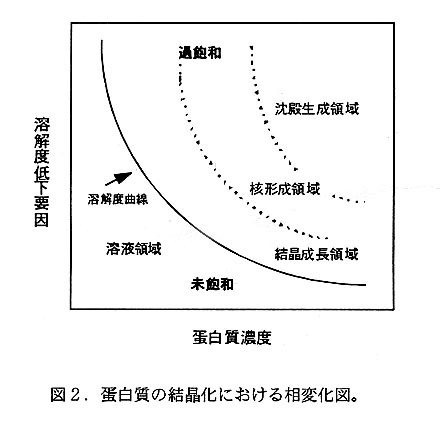
さて、蛋白質の溶解度に影響を与える各種要因は互いに複雑に影響し合っている のが実情ではあるが、ここでは結晶化という現象を理解しやすくするため、蛋白質 濃度と溶解性とによる相変化図(図2)を基に蚤白質の結晶化の過程を考えてみた い。図2において溶解度助線(飽和点の軌跡)の上側(過飽和領域)では蚤白質分 子同士は凝集可能な状態となる。過飽和領域に達する過程が急速過ぎたり、直ちに 沈殿生成領域に至ると、蛋白質分子同士の凝集は無秩序に進行し非晶質の沈殿を生 じる。一方、核形成領域に到達して暫くすると、電白質分子同士が規則正しく凝集 して結晶核が形成されることがある。結晶核が形成直後に核形成領域と溶解度曲線 との間の準安定状態(結晶成長領域)に置かれると、蛋白質分子が規則的に結晶核 の表面に層積して巨視的結晶への成長が期待される。即ち、結晶化とは過飽和状態 での核形成と結晶成長という2つの過程からなる現象であり、夫々の過程における 状態変化の経路と速度によって結晶化の成否が決定されると考えることができる。 換言すると、これらの過程をいかに制御して適当な結晶を得るかが蚤白質の結晶化 における命題と言えよう。
3.結晶化の方法
結晶化用に高度精製された蛋白質溶液は貴重なものであるから、蛋白質の結晶化 方法としては徹量の試料で多数の条件検討が可能なものが考案されてきた。ここで は比較的広く用いられている方法として、バルクバッチ法・マイクロバッチ法・蒸 気拡散法・自由界面拡散法・マイクロ透析法について紹介する。また、結晶成長が 芳しくない場合の解法として多用されるシーデイング法も併せて紹介する。夫々の 結晶化方法は単に見た目や操作手順が違うだけでなく、相転移図上での状態変化経 路が異なることに着目されたい(図3・4・6・10・11・13)。母液や平衡化溶液 の組成を同じにしても特定の結晶化方法でないと良好な結晶が得られないという状 況は上記の状態変化経路の相違として説明される。また、特に頻用される方法につ いては操作手順の椒略を図示した(図5・8・9・12・14・15)。各方法で用いら れる容器・器具についての詳細な情報は、Hampton Researcb Corp.のホームページ (http://www.hamptonresearch.com)から取得することができる(国内代理店:株式会 社リガク)。また、結晶化操作の自動処理については、マイクロバッチ法のIMPAX ト5(http://wwwdouglas.co.uk)や、ハンギングドロップ法のCyberlab Robot(http:// www.cyber-lab.com)といったラボロボットシステムが既に市販されている(国内代 理店はいずれも株式会社リガク)。
【バルクバッチ法】
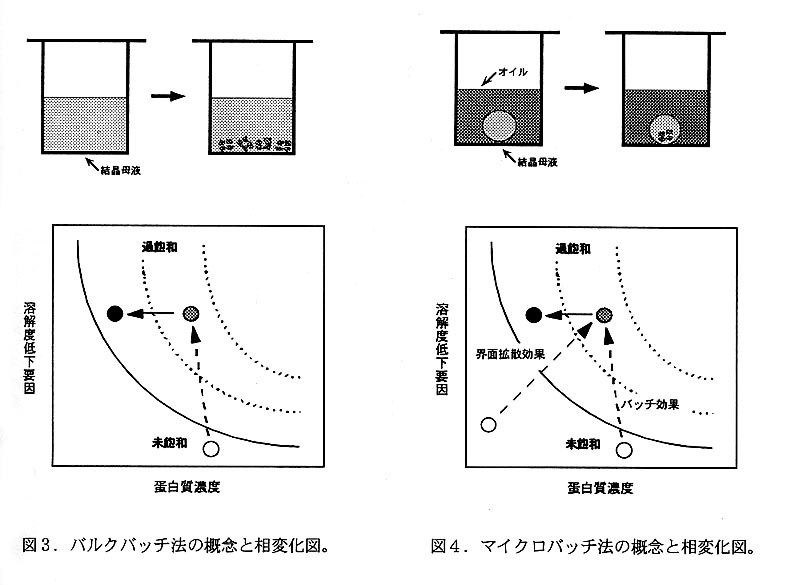
本方法(図3)は最も古典的な蛋白質の結晶化方法の1つであり、蛋白質精製法 として現在でも用いられる。蛋白質溶液に微量の沈殿が生じるまで沈殿剤を徐々に 加えた後、密封して静置するという方法であるため操作が単純な反面、沈較的多量 の試料を必要とすることが欠点として挙げられる。本方法にガラス容器を使用する 場合には、析出した結晶の器壁への付着防止のため予めシリコナイズ(有機シラン 化合物によるコーティングでガラス表面を疎水性に改質する)処理を施すとよい。
【マイクロバッチ法】
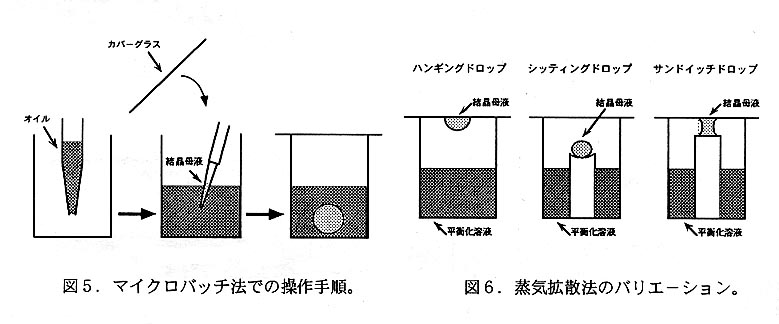
本方法(図4)では蛋白質溶液に沈殿剤を加えた微量の母液をパラフィン或いは シリコンオイル中に沈めて静置する(図5)。また、比重が大きいオイルに比重が 小さいオイルを重層しておき、両オイル層の中間の比重を持つ母液をオイル界面に 定位させることにより、母液と器壁との接触を回避する方法も考案されている。本 方法は微量試料でも適用可能なように改良されたバッチ法というだけでなく、母液 から油層への水分拡散も生じることから界面拡散法の性格も併せ持っている。水分 の拡散速度は使用するオイルの種類や混合組成を調節することにより制御可能であ る。容器としては母液量が1μL程度であれば寺崎プレートを、数μL以上であれば 細胞培養用の96穴プレートを使用するとよい。ランダムスクリーニング(後述)時 に多数条件の検討を一気に行う場合には、試料量が少なくて済む寺崎プレートを用 いたマイクロバッチ法が有用である。本方法では結晶を母液から取り出す際にオイ ルに結晶を接触させないよう注意する必要がある。
【蒸気拡散法】
本方法は最も頻繁に用いられる方法で、母液と平衡化溶液の鴇何学的配置によりハ ンギングドロップ法・シッティングドロップ法・サンドイッチドロップ法に分顛され る(図6)。蛋白質溶液に平衡化溶液を加えて母液とし、これと過剰量の平衡化溶液 とを同一容器中に分離密封し、母液が平衡化溶液に対して蒸気平衡に近づく過程で核 形成と結晶成長を計る(図7)。どの方法においても母液と平衡化溶液の表面積や両 者間を隔てる気相体積を変化させることによって蒸気平衡化速度を調節することが できる。ハンギングドロップ法とシッティングドロップ法の主な相違は、気一液界面 から母液内部に向かう蛋白質の溶解度勾配と重力の方向が反対であるため、気一液界 面付近で生成した結晶核の辿る運命が異なる点である。サンドイッチドロップ法は両 者の中間的な性格を持つ。
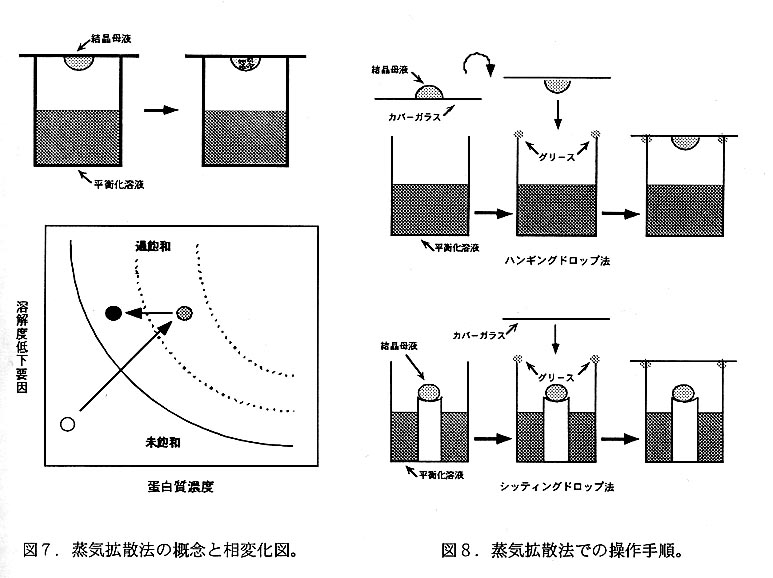
ハンギングドロップ法(図8)は最も頻用される結晶化方法であるが、カバーグ ラスに懸架できる母液は比較的少量(数〜10数μL)に限られる。容器としては汎用 結晶化プレート(Q Plate・Q Plate II・ACA CrystalPlate)が市販されているが、一般 の24穴細胞培養用プレートでも代用できる。カバーグラスにはシリコナイズ処理し たガラス製のものが通常使用されるが、プラスチック製のものも利用できる。24穴 フォーマットのプレートにはウェル間隔が大きいもの(Limbro・VDX)と小さいも の(Coster・Nulgen等)があり、前者には22mmの円形或いは正方形カバーグラス、 後者には18mmの円形或いは正方形カバーグラスがそれぞれ適合する。予めシリコナ イズ処理されたカバーグラスも市販されているが、厚手の(規格No.3〜4)のガラ ス製カバーグラスをシリコナイズ処理して使用すると操作が容易となる。カバーグ ラスと容器とを密着させるにはシリコングリース或いはシリコンオイルが用いられ る。前者の場合はチューブ入りのものを用意し、10mLの針無デイスボーザブル注射 簡に充填しておくと塗布しやすい(図9)。また、後者の場合には10mLの針付デイ スボーザブル注射簡に充填して使用するか、パイプクリーナーを容器の緑径に合わ せて整形したもの(図9)をオイルに浸して塗布する。
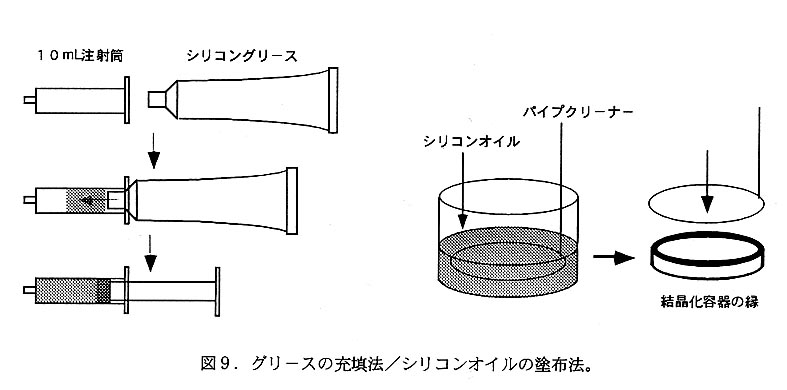
シッティングドロップ法(図8)では母液量を比較的自由(数〜数百μL)に設定 できる利点がある。24穴細胞培養用プレートのウェル内にガラス或いはプラスチッ ク製の台座(中央部分に母液を乗せるくぼみがあるもの)を置いたものか、市販の 汎用結晶化プレートやシッティングドロップ専用プレート(GystalCIcar Strips・ CrysChem)を結晶化容器として用いる。ウェルの密閉にはカバーグラスとグリース とを用いてもよいが、幅広の透明粘着テープ(ELISA用に市販されている厚手のも のがよい)を利用すると非常に簡単である。CrystalClear Stripsは96穴プレートの一 種で、使用液量が少なくて済む(ウェル当たり母液量数ルL、平衡化溶液量50〜100 μL)ことからランダムスクリーニング(後述)に有用である。これとは対照的に、 多量の母液(数十〜数百μL)を扱う場合には、くぼみ付きスライドグラスに乗せた 母液を平衡化溶液とともにプラスチック製の箱内に密封する方法を用いる。サンド イッチドロップ法にはQ Platc・ACA CrystalPlateが利用できる。
【自由界面拡散法】
本方法は蛋白質溶液と沈殿剤溶液の粘性や比重の差を利用して両者を層積させ、 2相界面付近での貰白質の溶解度減少によって結晶核形成を図り、その後の2液の 経時的混合過程において結晶成長を期待する方法である(図10)。安定した液一液 界面の形成が成否の鍵となるため、蛋白質溶液と沈殿剤溶液の粘性や比重の差が小 さい場合には適用が難しいという問題点がある。試料量が多い場合には通常のガラ ス管を、少ない場合には薄層クロマトグラフィーに使用するスポット用ガラスキャ ビラリーや結晶封入用ガラスキャビラリーを、それぞれシリコナイズ処理して結晶 化容器として使用する。ガラス管の開放端の封止には歯科用ワックスや2液混合式 エボキシ接着剤を使用するとよい。
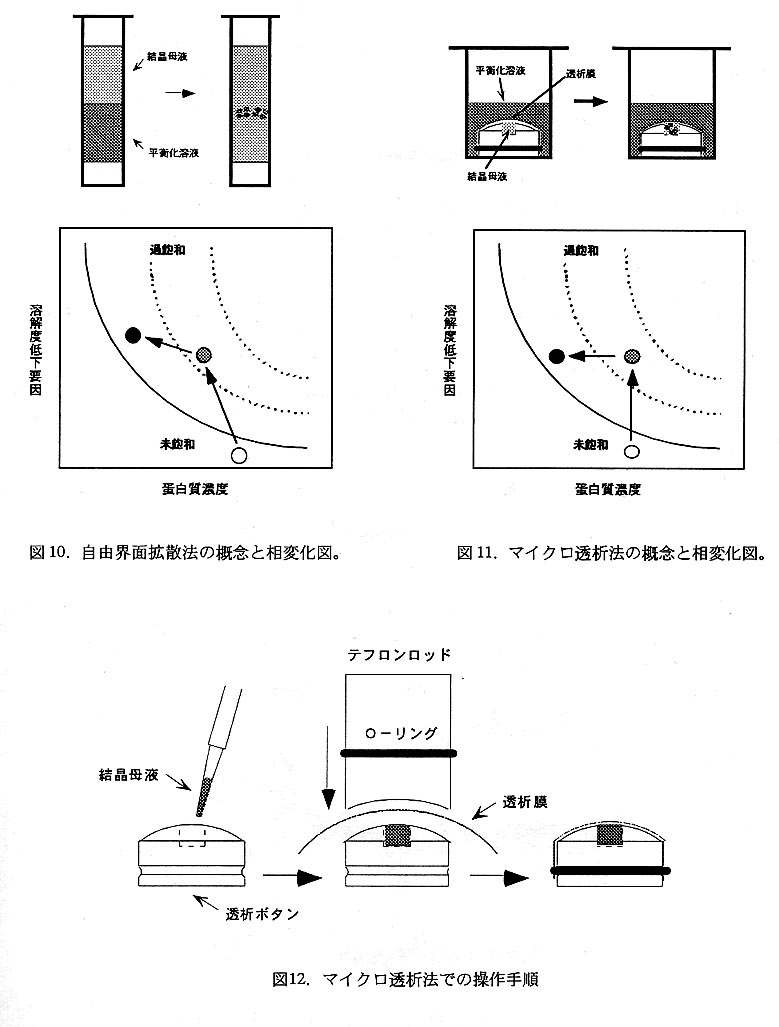
【マイクロ透析法】
透析法はバルクバッチ法と並ぶ古典的な蛋白質結晶化方法であるが、通常用いら れるサイズの透析チューブでは微量試料を扱えない。そこで各種の微量透析用容器 が考案されている。本法は微量透析用容器を用いた透析法(図11)であり、原理約 には通常の透析法と何ら変わるところはない。本方法の特徴は透析膜で透析外液と 隔てた母液を様々な条件の外液に曝すことによって、同一試料による複数条件の適 用が可能な点にある。また、母液の条件変化速度は母液/外液の体積比・母液/外 液組成比・外液交換の頻度等を調節することにより自由に設定できる。市販の専用 容器はその外形にちなんで「透析ボタン」と呼ばれ(図12)、蛋白質溶液を収納す るチヤンバー容積が異なるもの(5〜350μL)が用意されている。透析膜は通常の 透析チューブを直径約35mmの円形に切り抜いて使用するが、専用品も市販されてい る。透析外液用の容器には細胞培養用プレートやガラスパイアル等を利用する。
【シーデイング法】
他の結晶化法により小型の結晶は得られるものの結晶成長が芳しくない場合にし ばしば用いられる方法で、既存結晶を種として用いることにより結晶核形成過程を 省いて結晶成長過程のみの制御を試みる。使用する種結晶のサイズによりマクロシ ーデイング法とマイクロシーデイング法とに分額される(図13)が、どちらの方法 でも種結晶の移植のために予め母液を結晶成長領域に導いておく必要がある。種結 晶移植時の操作が容易なことから、主にシッティングドロップ法を基にした手順が 多用されている。
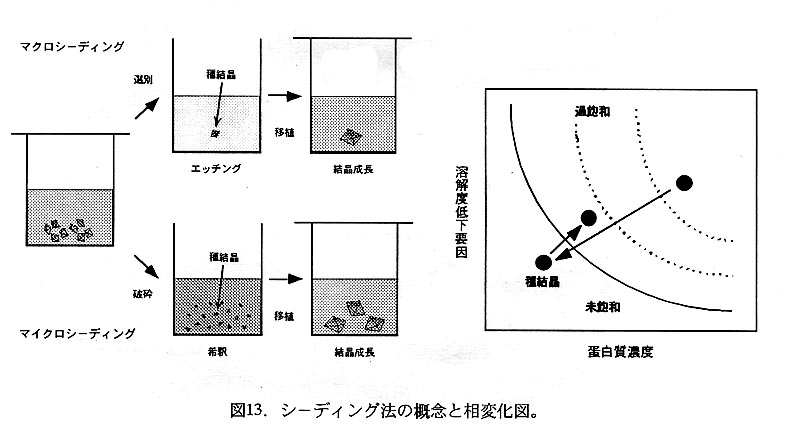
マクロシーデイング法(図14)は小型の結晶をエッチング溶液に曝して古い結晶 表面を溶解した後、結晶成長領域にある母液に潰すことにより新鮮な結晶表面への 蛋白質分子の層積を期待するものである。種結晶の結晶化に用いた平衡化溶液に緩 衝液を加えて沈殿剤濃度が少しずつ異なる一連の溶液を調製し、これらに予備の結 晶を潰してその様子を穎微鏡下で観察する。結晶の辺や角が緩やかに溶解して丸み を帯びる状態になるものをエッチング溶液として選択する。また、種結晶としては 外見の整った比較的大きな結晶を選別し、ピペット或いはクライオループ(結晶の 瞬間冷却に使用する器具:太さ10〜20μmの繊維を直径0.2〜1.Ommの環状にして金 属針の先端に固定したもの)によりエッチング溶液や母液に移植するとよい。
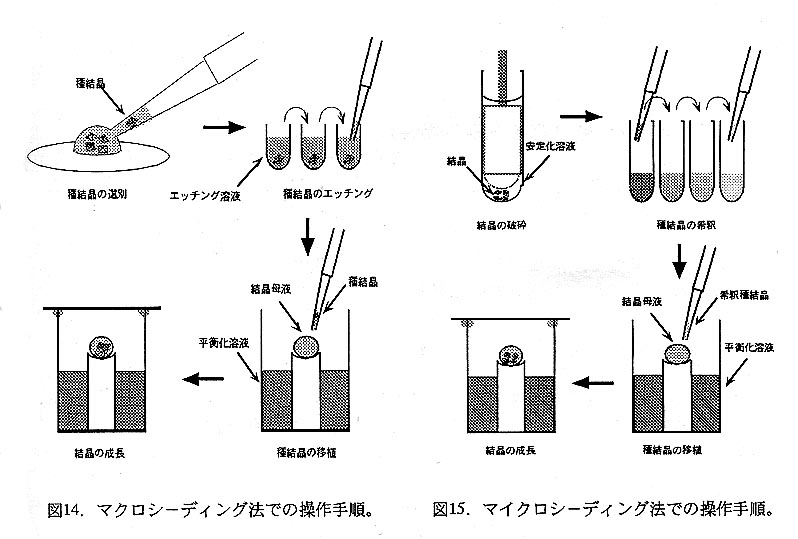
マイクロシーデイング法(図15)では結晶を破砕して得た超徹細結晶の懸濁液を調 製する。帝釈した超微細結晶の懸濁液を微量採り、結晶成長領域にある母液に加えて 結晶核となる超微細結晶の導入を図り、結晶成長を期待する。超微細結晶は表面積/ 体積比が大きいため、超微細結晶を不適切な組成の溶液に導入すると直ちに溶解して しまう。そこで、種結晶の調製時に用いた平衡化溶液よりやや高濃度の沈殿剤(5〜 20%程度)を含む溶液(収穫溶液)がこの目的に用いられる。種結晶を収穫溶液で洗 浄した後にホモジェナイザーを用いて収穫溶液ごと破砕し、収穫溶液を用いて10倍 毎の帝釈系列を調製する。希釈懸濁液中の超微細結晶濃度は判らないので、千〜百万 倍額釈液を夫々用いて移植し、結晶成長の結果から次回試行の最適条件を求める。調 製した超微細結晶の懸濁原液及び帝釈液は、以後の試行に種結晶のストック懸濁液と して使用するので大切に冷所保管する。なお、種結晶として破砕した超微細結晶懸濁 液の代りに、ネコ・ウサギのヒゲや人間の頭髪で結晶表面を掃くことによって微細な 結晶破片を撞き採り、これを結晶成長領域にある母液に移植する変法(ストリークシ ーデイング法)も考案されている。この方法は収穫溶液の条件検討や帝釈系列の調製 が不要なため母液の条件検討には有利である。一方、微細結晶の掻き取り方がヒゲや 頭髪の性状や摩耗に影響されるため結果の再現性にやや難がある。また、ここでは同 質結晶を用いたシーデイング法を記述したが、異種蛋白質の微結晶や無機塩等の微結 晶を種(結晶核)として使用したマイクロシーデイング法の実例も知られている。
4.結晶化条件探索の戦略
結晶化に適当な蛋白質溶液を手にした際に考えなければならないことは、どのよ うな戦略で一連の結晶化実験をデザインするかという点である。対象とする蛋白質 についての情報・利用可能な試料量・結晶化の目的等に依存して、採るべき戦略は 当然異なってくる。
【新規の蛋白質で結晶化を試みる場合】
参考となる結晶化既知の蛋白質が見当たらない場合には試行錯誤を繰り返しなが ら結晶化条件を深索せざるを得ない。新規蚤白質の結晶化の場合には例外なくこの 状況に陥ることになる。また、結晶化条件が既知の蛋白質でも新規結晶形を得たい 場合(回折強度測定時の分解能に不満がある場合、大型の基質アナログ/阻害剤と の結合が分子充填上困難な場合等)にはやはり試行錯誤による探索が必要となる。 「結晶構造解析における律連投階は結晶化」と言われるのは、こうした試行錯誤が どれだけの期間・どれだけの試料を用いて行う必要があるかを予測するのが困難な ためである。このような状況において結晶化に用いられる典型的な戦略2つを以下 に紹介する。
第1の戦略は、多くの成功例が報告されている代表的な沈殿剤と標準的な緩衝液 を選択し、沈殿剤濃度とpfIとの組み合わせマトリックスを作製して対象蛋白質に適 用するものである。このように、少数の変数を系統的に変化させて作製した条件マ トリックスを全件探索する戦略を、以後「系統スクリーニング」と呼ぶ。例えば、 沈殿剤にPEG6000・2−メチルー2,4−ペンタンジオール(WD)・硫酸アンモ ニウムの3種類を選び、各沈殿剤毎に沈殿剤濃度4通りにpH4〜9(刻み幅1)の 6通りの合計24条件を1枚のプレート上に調製すると、全部で72条件の深索を行う ことになる。各種沈殿剤を用いたスクリーニングキットがHamptonResearch Corp・ からGrid Screens・QuickScreenの名称で販売されている。本戦略は探索範囲が非常 に狭い鞄囲に備在した、いわば「狙い撃ち」法であるから、運良く約に当たれば1 回の試行で良質な結晶が得られる場合すらある反面、次回の試行に参考となるよう な実験結果が全く得られないことも往々にしてある。
第2の戦略は、多種多様な沈殿剤・緩衝液・添加剤の組み合わせの中から互いに かけ離れた数十程度の条件を統計手法(incomplete factorial analysis)に基づいてサンプリング(sparse matrix sampling)し、対象蛋白質に適用するもので、以後「ランダムスクリーニング」と呼ぶ。この方法に基づき設計されたスクリーニングキットは Hampton Research Corp.からCrystal Screens・Membfac・Low ionic strength screen 等の名称で販売されている。また、独自の条件を設計したい場合にはSegelkeとRuppが開 発したCrystool(http://www-structure.llnl.gov/crystool/crystool.htm)等のプログラムにょって溶液組成の組み合わせを決定する。本戦略は検索条件の網羅性に優れ、結晶化条件の発見が困難であるほどサンプリング効果は高くなる。実際上の問題点とし ては、各条件における蛋白質の溶解度は事前に全く予測できないため、蚤白質溶液 との混合直後に沈殿が生成したり、母液が数週間も澄明であり続けたりすることが 挙げられる。前者の場合は沈殿剤濃度を下げるため適宜水で帝釈する。後者の場合 には沈殿剤濃度を高めたものを調製し直すか、その条件自体を検討対象から除外す る。沈殿剤襟度の適正化には各条件について数回の試行が必要となるため、事前に 十分な試料量を確保しておくか、定期的な試料供給を計る必要がある。
【参考となる結晶化条件が既知の場合】
良好な結晶を与える条件が既知の蛋白質それ自体(小分子を濠漬法で結晶に導入 する際の親結晶として使用される)或いはアミノ酸残基の置換を導入した変異体蛋 白質を扱う場合や、小型の基質アナログ/阻害剤等との複合体の共結晶化を行う場 合には、既知の結晶化条件を模倣するのが合理的な戦略と言えよう。また、対象蛋 白質とアミノ酸配列の相同性が高い蛋白質の結晶化条件が既知の場合にも同様の戦 略が有効と期待される。特に、複数の類縁蛋白質において結晶化条件が知られてい る場合には、夫々の一蛋白質の結晶化条件にみられる共通性/特殊性を勘案し、対象 者白質での実験計画を立案することが可能となる。蛋白質の結晶化条件に関するデ ータベースとしては、米国National Institute of Standards and Techlology(NIST)が管理・運営するBiological Macromolecule Crystallization Database(BMCD)が知られている(http://www.ibm4.carb.nist.gov:4400/bmcd/bmcd.html)。本データベースの検索可能な項目を以下に列挙する。
データベース検索やスクリーニングの結果から結晶化の初期条件が得られると、 良質な結晶を得るために実験条件をさらに精密化する必要がある。その場合にも上 記2つの戦略は適用できる。検討すべき変数として蛋白質濃度・沈殿剤濃度・PH・ 添加剤・温度等を考慮し、未知の変数が多い場合や変数同士の相互作用が不明な場 合にはランダムスクリーニングの手法を用いて条件の絞り込みを試みる。また、結 晶化条件が明確になりつつある場合には系統スクリーニングによる全件探索を実施 する。代表的な添加剤(無機/有機塩・有機溶媒・還元剤・界面活性剤)の溶液は Hampton Research Corp. からAdditive Screens、Detergent Screensの名称で各種販売されているが、結晶化条件の精密化ではきめ細かい条件設定が必要となるため自作す る場合が多くなる。また、結晶成長が芳しくない場合には結晶化方法を変更したり シーデイング法を適用するとよい。さらに、低イオン強度での溶解性が低く、充分 な蛋白質濃度を確保し難い場合には、脱塩或いは帝釈による結晶化を試みる。
5.実験上の留意点
【蛋白質溶液】
一般に、結晶化に用いる雷白質溶液はできる限り「高純度」であることが望まし い。ここで言う「純度」には以下の3つの意味が含まれている。第1に「夾雑蛋白 質が少ない」ことが挙げられる。原理が異なる複数の精製法を組み合わせ、目的蛋 白質と挙動を共にする爽雑蛋白質も排除するように努める。第2に「化学約/物理 的に同質」であることが挙げられる。同等の生物活性を有する蛋白質分子でも、末 端残基の欠落・ペプチド鎖の切断・残基修飾(糖鎖付加・両末端/側鎖の化学修飾 等)を受けたものは化学的に同質とは言えない。また、化学的に同質であっても分 子のコンフオメーションが不揃いであれば物理的に同質とは言えない。例えば、ル ープ構造が開いた分子と閉じた分子とが混在する場合や、・部分的に変性した分子が 混在する場合がこれに当たる。非同質の分子の性状は目的とする分子のそれに極く 類似しているため、結晶成長には特に悪影響を及ぼすと考えられる。第3に「分散 状態が均一」であることが挙げられる。蚤白質分子の分散性を調べると、単分散だ と結晶が得やすく、多分散だと結晶が得にくいという経験則がよく成り立つようで ある。そこで、結晶化用の蛋白質溶液の最終評価方法として動的光散乱法が広く用 いられるようになってきた。Protein Solution Inc. のDynaPro801(国内代理店:株式 会社リガク)による動的光散乱法の利用法については、本誌に三浦圭子氏の解説が 掲載されているので参照されたい。
さて、「結晶化に必要な蛋白質量はどの程度か?」という質問によく遭遇する。 ここで結晶化に必要な総蛋白質量が式1で計算される量と佼定すると、結晶化条件 決定での必要量や良質結晶1個を得るための必要量は適当な結晶化条件が発見され るまでは不明である。また、結晶の必要個数は結晶の性状・測定方法・解析方法に 依存するので、これも事前には知り得ない。従って、結晶化に必要な蚤白質量につ いては事前に適当な数値を挙げること自体、極めて困難と言わざるを得ない。
(必要な総蛋白質量)=(結晶化条件の決定に必要な量)+
(良質な結晶1個の調製に必要な量)×(良質な結晶の必要個数)..... 式1
これに対して、より現実的な設問と思われるのが、「最低限必要な電白質量はどの 程度か?」といったものであろう。この量は式2によって見積もることができる。 蚤白質溶液の濃縮にはデイスポーザブルの小型限外濾過装置(Amicon Centricon・ Millipore Ultrafree等)を使用するが、その際に採取可能な液量は50〜100μL程度で ある。また、濃縮時の沈殿形成や限外濾過膜への吸着・採取時のロス等により、濃 縮時の回収率は数十%程度となる。一方、結晶化に適した蛋白質濃度は対象蛋白質 の溶解性に依存するが、難溶性蛋白質で数〜十数mg/mL程度、通常の音白質で10〜 50mg/mL程度、極めて溶解性の高い蛋白質では50〜200mg/mL程度と考えておけばよ い。蛋白質溶液の最終濃縮過程時や動的光散乱法による測定時に溶解性についての 知見が得られるので参考にする。
(最低限必要な蛋白質量)=(結晶化に適した宅白貿濃度)×
(濃縮容器から回収可能な液量)÷(濃縮時の回収率).... 式2
例えば、20mg/mL 蛋白質溶液を100μL 調製するには3〜5mg 程度の蛋白質が必要と なる。1条件当たりの試料液量は使用する結晶化方法や条件によって異なるが、ス クリーニング時では0.5μL(マイクロバッチ法・蒸気拡散法)〜5μL(マイクロ透 析法)、良質な結晶の調製時では2〜20μL程度である。従って、上記の蛋白質溶液 を用いてスクリーニングを行うとすると20〜200条件の探索が可能となる。以下に結 晶化用蛋白質溶液の調製における留意点を列挙する。
1回の結晶化条件検討では、沈殿剤や添加剤の濃度、PH等が僅かずつ異なる数十 〜百数十種規の平衡化溶液を調製することになる。従って、緩衝液・沈殿剤溶液・ 添加剤溶液の夫々について、適当な濃度のストック溶液を予め調製しておけば、そ れらを適宜混合するだけで直ちに結晶化操作に進むことができる。一般の生化学実 験でも同様であるが、最も時間を要する過程は結晶化操作それ自体ではなく、スト ック溶液の調製である。系統スクリーニングやランダムスクリーニングのための市 販キットの利用は初期の条件検討に便利であり時間の節約にもつながるが、結晶化 条件を精密化していく過程では多くのストック溶液を自作が必要となる(例えばpH 間隔が0.3刻みの緩衝液系列や特定の補酵素或いは阻害剤の溶液等)。実験精度や結 果の再現性を保証するため、使用する試薬や溶媒・機器等の取り扱いや、ストック 溶液の組成設計・調製法・保存法には十分注意を払う必要がある。以下に試薬及び ストック溶液の調製における留意点を列挙する。
実際の結晶化操作自体は単純な動作の繰り返しであるが故に、うっかりした間違 い(例えば結晶化プレートのウェルを取り違える等)を起こしやすい。また、機器 の校正が不十分であると、実験条件の系統的変化に気付かない場合もあろう。機器 の使用や結晶化の操作には細心の注意を払うことが肝要である。また、チリやホコ リは目的とする蛋白質結晶の良好な成長を阻害ことがあるため、できる限り系から 除外するように努める。さらに、得られた結晶と同様、結晶化条件記録や観察記録 も研究上の貴重な財産であることを忘れてはならない。以下に結晶化操作における 留意点を列挙する。
これまで研究者の不断の努力により数多くの蛋白質が結晶化されてきた。しかし ながら、蛋白質の結晶化には特殊な知識や高度な技能が格別に要求される訳ではな い。重要なことは、高度精製された目的とする蚤白質の溶液とその蛋白質の基本的 性状に関する知識だけである。合理的な実験計画に基づく着実な実験と観察の実践 こそが、良質な蛋白質の結晶を得るための唯一の方法である。なお、蛋白質の結晶 化の詳細については文末に掲載した参考書を参照されたい。特に、文献1は蛋白質 の結晶化を実践的かつ包括的に扱った良書であり、是非一読されたい。
7.参考書 【蛋白質の結晶化】
【蛋白質の結晶構造解析:結晶化も含む】