1.はじめに
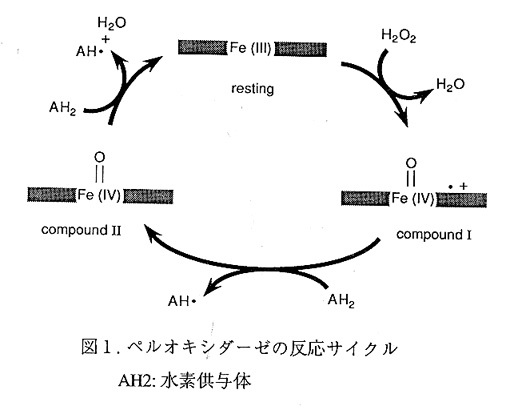
生物が存続するうえで、呼吸・光合成を代表とする一連の酸化還元反応は必須であ る。ペルオキシダーゼは過酸化水素を用いて物質の酸化反応を触媒する酵素であり、生 体内酸化還元反応の過程で生じる過酸化水素を除去するという生理的役割を担っている。 また図1に示したように、ペルオキシダーゼの反応過程で生じるラジカル(図1のAH・) を用いて、様々な生体物質の代謝(リグニンの生合成・分解やホルモンの生合成など) に関与していることも見逃すことのできない1))。例えば、甲状腺の酵素はI-を酸化して チロキシンホルモンを合成し、また白血球中のミエロペルオキシダーゼはCl-を酸化し て生体防御に関与している。これら以外にも海藻が含有するプロモフェノール類やハロ ゲンイヒテルペンが知られており、これらの合成に関与している酵素だけでなく、ハロゲ ン元素の循環からも注目されている2)。
ペルオキシダーゼは高 等生物から微生物にいたる 生物界に広く分布し、多く の種類が知られている。セ レノシステインが活性部位 を構成しているグルタチオ ンペルオキシダーゼや、最 近ハロゲン化酵素として注 目されはじめたバナジウム を含む酵素を除いて、主な ペルオキシダーゼは補欠分 子族としてへムを持ってい る。この中でも植物型ペル オキシダーゼについては非常によく研究され、例えば一次構造はこれまで100種以上報 告されている。以後ことわらない限り、この型のヘムペルオキシダーゼを単にペルオキ シダーゼと呼ぶ。

ペルオキシダーゼは、グルコースやコレステロールなどの生体成分の定量に広く用 いられていることでも有名である。例えばコレステロールの量は、コレステロールオキ シダーゼによりコレステロールの量に応じた過酸化水素を発生させ、これをペルオキシ ダーゼとルミノールで化学発光として定量できる3)。本酵素は酸化される物質(水素供 与体)に対して基質特異性が低いので、多様な定量法が可能である。このようにペルオ キシダーゼは多様な生体内反応に関与しているだけでなく、応用面も広いことから、現 在でも様々な角度から研究が続いている。
2.これまでのペルオキシダーゼの構造研究
植物型ペルオキシダーゼは、少数の例外を除くと250-350残基からなる一本のポ リペプチド鎖と、非共有結合的に結合したへムから成る。これらの一次構造に有意な相 同性が認められることから、植物型酵素は共通の祖先から進化したと考えられている。 植物型酵素は相同性に基づいてさらに3つのクラスに分類されている4)。相同性はクラ ス内で約40%。、クラス問ではアミノ酸残基の挿入・欠失を考慮して約20%である。活 性部位近傍のアミノ酸配列は比較的よく保存されており、ヘムの近位側のヒスチジンお よび遠位側のヒスチジン・アルギニンは植物型酵素問で完全に保存されている。
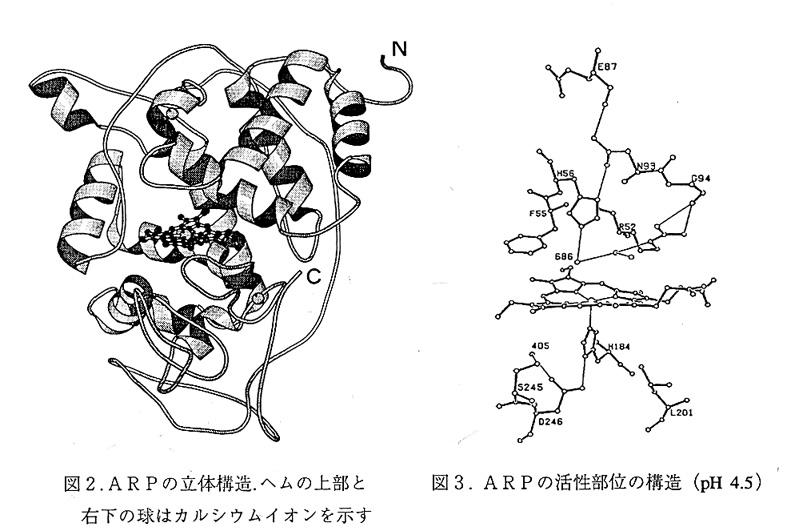
これまでに植物型クラス1および2に属する酵素の立体構造が5例報告されている。 図2に我々が現在取り組んでいる真菌Arthromyces ramosusが分泌するペルオキシダーゼ (ARP)の分子構造を示す5)。ARPは10本の主要なαへリックスと2本の短いαへリッ クス、及び少数の短いβストランドを含み、中央にヘムをはさんでいる。これらの基本 構造はこれまで立体構造決定されたすべてのペルオキシダーゼで保存されており、αへ リックスに富む構造であるといえる。クラス2には(ARPはクラス2に属する)C末端 部に約40残基の延長ペブチドが存在し、ループ状に分子表面上を這っている(活性中 心であるヘムおよびその周辺との直接的接触はない)。またカルシウムが埋もれた環境 に2箇所結合しており、これらのカルシウム結合部位はクラス2に属する他のペルオキ シダーゼで共通している6)。これらは分子構造の安定化に寄与しているのであろう。ク ラス3の西洋ワサビペルオキシダーゼ(HRP)では変性状態からin vitroでリフォール ディングする際にカルシウムの添加が必須であると報告されている7)。しかしカルシウ ム結合部位について、クラス2のそれと共通性があるかどうかは不明である。なおクラ ス1のチトクロムcペルオキシダーゼ(CcP)ではカルシウムを含んでいない。ARP中の 8残基のシステインはすべて架橋しているが、CcPでは架橋したシステインはない。
以上のような構造に関する研究だけでなく、これらの酵素特性や反応中間体(図1 中compound Ⅰとcompound Ⅱ)などについての分光学的解析も非常に多くなされている。 さらにCcPでは変異体の反応速度と立体構造の解析もなされ、ペルオキシダーゼ反応に おけるアミノ酸残基の役割が判ってきている8-10)。以下我々が現在取り組んでいる ARPを中心に、活性部位および基質結合部位の構造と酵素反応について述べる。
3. 活性部位の構造11)
ARPのヘム近傍の立体構造を図3に示す。ヘムの上下には各々遠位ヒスチジン (His 56)と近位ヒスチジン(His 184)があり、これらはArg 52と共に全ての植物型ペ ルオキシダーゼで保存されている。酵素反応部位は遠位側にあり、His 56はcompound Ⅰ 生成の際の酸塩基触媒、Arg 52はcompound Ⅰ生成反応において基質の開裂の補助をして いるとされている8)。興味深いことに、遠位ヒスチジンのNδとAsn 93との水素結合が 保存されているが、遠位ヒスチジンのイミダゾール環の配向がペルオキシダーゼによっ て異なっている。
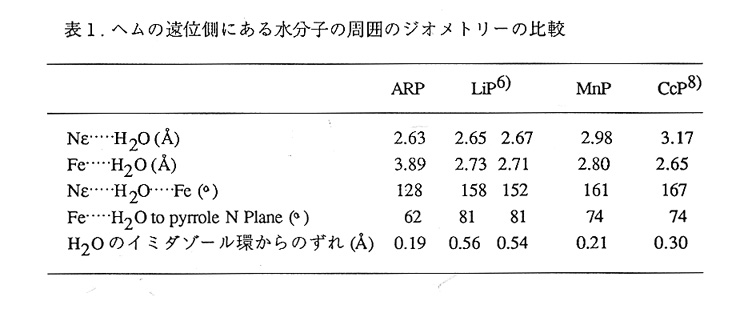
これまでの分光学的解析から、ペルオキシダーゼはresting状態では通常5配位の高 スピン状態をとっているとされている12)。一方X線解析の結果、どのペルオキシダー ゼでもヘム鉄第6配位座に電子密度があり、これは水分子によると解釈されている。水 とヘム鉄の相互作用が弱ければ両者の結果は必ずしも矛盾するものではないが、ARPの X線解析6pH7.5、32%飽和硫安)からARPが5配位の高スピン状態をとっていると は言い難い結果が得られた。すなわちこの場合もヘム鉄第6配位座に電子密度が見られ たことに加え、鉄原子のへム面からのずれが予想値より小さかった。さらにARPの結 晶化条件(pH7.5、32%飽和硫安)では、精製酵素の溶液より赤味がかっていた。
そこでまずARPの吸収スペクトルのpH依存性を調べたところ、硫安が存在しない とpHが変化しても高スピン型のままであったが、硫安があるとpHが高くなるにつれ 低スビン型へと移行した(図4)。このことはpHが高いと、アンモニアがヘム鉄に結 合することを示唆している。すなわち結晶中(pH7.5)におけるヘム鉄の配位構造が本 来の酵素のそれと異なっていることを示唆している。
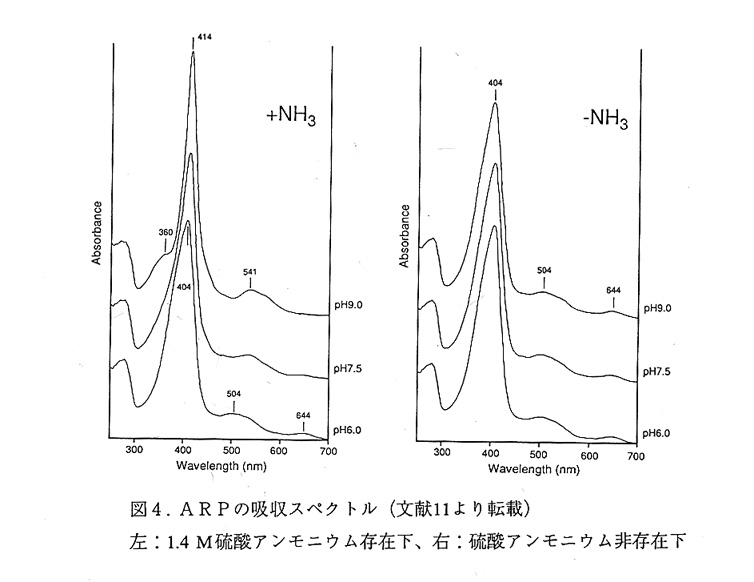
次に高スピン型を示す条件でARPの構造解析をした。一夜pH4.5の硫安溶液に浸 したARP結晶の回折強度を、1.8Å分解能まで測定した(独立な反射数28,453, completeness=90.4%,Rmerge=6.98%)。この回折データを用いて構造を精密化したと こる、7.0から1.8Å分解能の27,884反射(F>2σmergeF)に対してR因子は18.8%となった。 pHを下げると、へム鉄の第6配位子座に電子密度は無くなり、代わりに遠位ヒスチジ ンのイミダゾール環の面上でNeと水素結合できる位置にピークが現れた(図3中の686)。 これらのことからpH7.5で見られたへム鉄の第6配位子座の電子密度はアンモニアの ものであり、これがへム鉄に結合することによってスピン状態が変化したといえる。な おpH変化による蛋白部分のコンフォメーション変化は無かった。
表1にへムの遠位側にある水分子をとりまく環境を示した。この表から全てのペル オキシダーゼにおいて、この水分子は遠位ヒスチジンのイミダゾール環との相互作用で 位置が決まっているように見える。ARP以外の酵素ではイミダゾール環の面内にヘム鉄 が位置しているため、へム鉄の第6配位子座に水があるように見える。また鉄原子はへ ム面からずれている。これらのことから、生理条件下では全てのペルオキシダーゼにつ いて、第6配位座に水が存在してもヘム鉄との相互作用は非常に弱く、resting状態では 5配位高スピン状態をとっているといえよう。なお硫安が存在しても、ARPの compound Ⅰ生成の反応速度は大きく変わらないようである。
4. ヨウ素イオンの結合部位13)
一方ペルオキシダーゼの反応過程で、compound Ⅰが還元される際、還元剤(図1中 のAH・)が酵素のどの箇所に結合し、酸化されるかということは重要かつ興味深いこ とである。これまでに幾つかの還元剤とcompound Ⅰとの反応や結合部位が分光学やキネ ティクスから調べられている14,15)。還元剤の中にはヨウ素イオンも含まれ、ヨウ素化 はチロキシンなどの合成に関係し、あるペルオキシダーゼの重要な生理的役割である。 ARPの場合、ヨウ素イオンは生理的基質ではないと考えられるが、過酸化水素を用いて ヨウ素イオンをI3-に酸化する触媒能を有している。これまでに還元剤の結合部位が結 晶学的に同定された例はなく、我々はまずГがARPのどの箇所に結合するかを決定し ょうとした。
127I-NMRからI-がARPに比較的弱く結合する(Kd~50mM)ことが明らかにさ れていた。そこでARP結晶を30mMKI溶液に浸し、この回折強度データをCu Kα線と R-AXIS Ⅱcを用いて2.06Å分解能まで収集した(独立な反射数20,178、Rmerge=6.2%)。 このデータから2種類の差のフーリエ合成を計算した。一つは通常の(Fo-Fc合成 (2.06Å分解能)であり、もう一つは(Fo(+)-Fo(-))を係数とする異常散乱による差のフ ーリエ合成(4.0Å分解能)である。なおFcおよび位相角はネイティブARPの原子パ ラメータを基に計算した。(Fo-Fc)合成にはARP1分子当り1つのピークが明瞭に表れ た。さらに(Fo(+)-Fo(-))合成に幾つかのピークが表れ、一番高いピークはヘム鉄の箇所 に、2番目は(Fo-Fc)合成上のピーク位置と完全に一致した。CuKα線に対するヨウ素 および鉄原子のΔf"の値はそれぞれ6.84と3.20であり、(Fo(+)-Fo(-))合成上のピーク値 から、ヨウ素イオンの占有率は約30%。であると推定される。この値はKdが約50mM であることとほぼ一致する。なお(Fo(+)-Fo(-)合成上の3番目と4番目のピークはカル シウムイオンの位置に表れ(Δf"Ca=1.29)、5番目はS-S結合上に表れた。
I-の結合部位を図5に示す。I-はへムの遠位側へ通じるチャネルの入口上部にある。 I-は2本のペプチドPhe90-Pro91-AIa92とSer151-Leu152-Ile153に挟まれた小さなくぼみ にあり、特定のペプチド原子と強い結合はないようである。I-に近いIle153の側鎖のタ ンパク内部側には、活性残基のHis56がある。
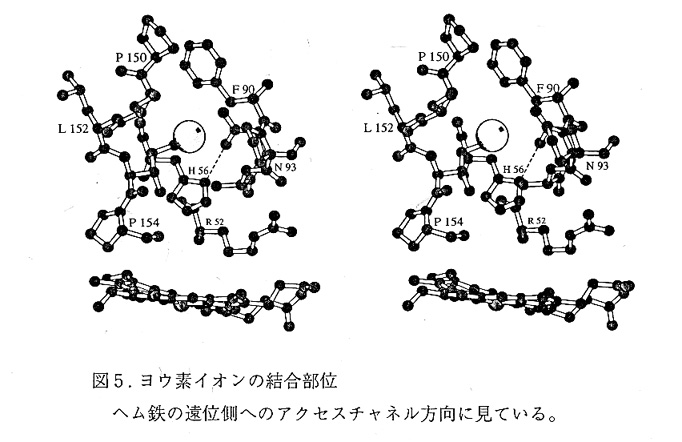
Compound ⅠがI-により還元される際、compound Ⅰでも上記の(resting状態での) 部位にI-が結合すると考えられよう。この場合Γからいかにオキシフェリル基へ電子 伝達されるのであろうか?ARPのcompound Ⅰの構造解析はされていないが、ARPの CN-結合型の解析結果から16)、酸素原子とHis56のNεと水素結合していると予想され る。またI-とへムとを結ぶ水素結合が近くに見あたらないことから、I-から空間を介し てHis56のイミダゾールヘ電子が伝達される可能性が第一に考えられよう。またI-と NH(Ala92)が近いことから、Ala92-Asn93そしてO(Asn93)…‐Nδ(His56)の水素結合を介し て電子伝達されるとも考えられる。理論計算やミュータントを用いた実験等、多角的な アプローチに今後の発展を期待したい。
謝辞:本研究は多くの方々との協同で行われました。終始激励していただいた松原央教 授(現岡山理科大学)、熱心に実験・解析を進めた国島直樹博士(現蛋白工学研究所)、天 田史子さん(現P&G)および板倉寛之君、ヨウ素結合について御協力いただいた細谷東一 郎教授および高橋征三教授、X線実験でお世話になった蛋白質工学基礎研究センターの皆様、 放射光による実験でお世話になった高エネルギー物理学研究所の坂部知平教授(現筑波大学)、 中川敦史博士(現北海道大学)、渡部信久博±および池水信二博士、ARPを提供していた だいたサントリー株式会社に感謝致します。
参考文献